Einleitung
Das Thema MDR (Medical Device Regulation) ist aktuell in aller Munde und hält generell die Medizinproduktehersteller sowie Ihre Lieferanten auf Trab. Dies aus verschiedenen Gründen. Einerseits ist die von der EU gesetzte Timeline sehr ambitioniert und andererseits ist auch vieles was in der Verordnung geschrieben steht noch nicht klar, wie es in der Praxis dann angewendet wird.
Was ist eigentlich die MDR?
Die neue europäische MDR ersetzt die bestehende MDD (Medical Device Directive) und die AIMD (Active Implantable Medical Devices) Diese beiden Direktiven sind in Zukunft in der MDR vereint.
Der Vorteil der Verordnung ist, dass nun das Gleiche für alle Europäischen Mitgliedsstaaten gilt. Bei den Direktiven, mussten diese jeweils noch in lokales Recht umgesetzt werden. Dies führte zu unterschiedlichen Bewertungen in den einzelnen Ländern.
Ziel der MDR ist es, die Produktsicherheit für die Patienten zu erhöhen. Dies steht im Mittelpunkt der ganzen Verordnung. Es soll auch die Transparenz erhöht werden. Es wird eine zentrale Datenbank (EUDAMED) geschaffen. Hier ist es auch jeder Privatperson möglich, Informationen über jedes in der EU-Zugelassene Medizinprodukt einzuholen.
Änderungen im Vergleich zur MDD
Es gibt einige Änderungen in verschiedenen Bereichen. Ich möchte gerne auf vier wesentliche Änderungen eingehen.
Erweiterter Anwendungsbereich
In der MDR sind nun auch die AIMD’s geregelt. Und zusätzlich werden auch Produkte, welche nicht zwingend einen medizinischen Nutzen haben unter die MDR fallen. Bespiele hierfür sind kosmetische Kontaktlinsen, Laser zur Tattoo Entfernung oder auch Implantate zur Bodymodifizierung.
Klassifizierung
In der MDR gibt es neu 22 Regeln zur Klassifizierung von Medizinprodukten. In der MDD waren es noch 18. Dies ist einer der Gründe, dass jedes Medizinprodukt neu bewertet und klassifiziert werden muss.
Klinische Evaluation von Medizinprodukten
Die Anforderungen an die klinischen Daten, welche für die Zulassung eines Medizinproduktes benötigt werden sind höher. Die MDR beschreibt auch genauer welche Qualität die Daten für die klinische Bewertung haben sollten. Das Ziel hiervon ist es, zu beweisen, dass die beanspruchte Wirksamkeit auch tatsächlich gegeben ist. Ausserdem sollen etwaige unerwartete oder unakzeptable Nebenwirkungen ausgeschlossen werden können.
Marktbeobachtung
Post Market Surveillance ist nun wichtiger als zuvor. Auch die daraus gewonnen Daten müssen in die klinische Bewertung der Produkte miteinfliessen. Diese werden anhand dieser aktualisiert. Es ist auch nicht ausreichend nur die eigenen Produkte zu Monitoren. Vergleichbare Konkurrenzprodukte müssen ebenfalls in die PMS miteinbezogen werden. Es müssen sich bei Vorkommnissen Gedanken gemacht werden, ob für das eigene Produkt ebenfalls Massnahmen ergriffen werden müssen.
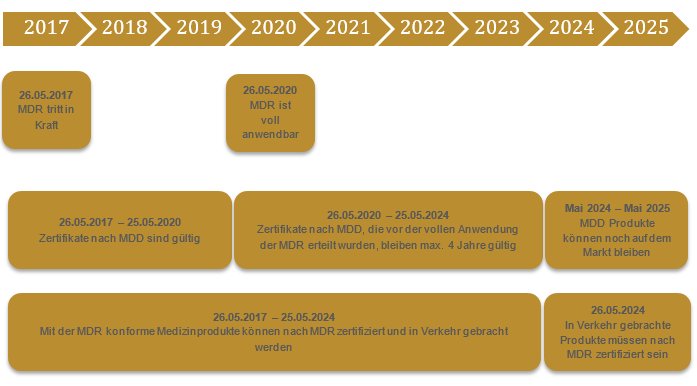
Die Übergangsfrist von der MDD zur MDR beträgt drei Jahre, bis zum 26.05.2020. In der Theorie kann man schon länger seine Produkte nach der MDR zertifizieren. Nur ist die Auswahl an notified body, welche nach MDR Zertifiziert sind noch sehr klein. Nach unserem Kenntnisstand haben sich insgesamt 34 Firmen um eine Zertifizierung als notified body beworben. Zwei sind bisher zertifiziert. Angesicht der Timeline und der Masse an Medizinprodukteherstellern, welche Ihre neuen Zertifikate benötigen scheint dies eine überambitionierte Übergangsfrist zu sein. Die EU hat dies auf Ihrem Radar. Es gab in der Vergangenheit auch schon Gerüchte, dass die MDR um drei Jahre verschoben werden soll.
Wie geht artimelt mit der MDR um
Artimelt hat sich ebenfalls über diverse Seminare und Dienstleister über die MDR und ihre Folgen im Detail informiert. Wir wissen daher sehr gut Bescheid, was die MDR für unsere Kunden im Medical Bereich bedeutet und sind auch gewillt nach Kräften zu unterstützen und unser Wissen rund um die MDR zu teilen.
Artimelt erarbeitet eine eigene Datenbank für Ihre Produkte und Rohstoffe, um eine organisierte und leicht zu pflegende Übersicht zu haben. Diese Datenbank soll die verschiedenen Anforderungen der diversen Regulatorien abdecken. Sei es REACH, MDR, California Proposition list 65 oder auch Einzelanfragen wie die Abwesenheit von Schwermetallen oder anderen kritischen Inhaltstoffen.
Ausserdem ist artimelt bestrebt so viele Biokompatibilitätsdaten wie nötig bereits zur Verfügung zu stellen. Dies erleichtert bei diversen Produktklassen das Erstellen der technischen Dokumentation und ist ein guter Ausgangspunkt für das Erstellen der klinischen Bewertung von Ihrem Medizinprodukt.
Wir bleiben weiter am Ball und freuen uns auf den gemeinsamen Austausch zur MDR und wie wir die Herausforderungen gemeinsam meistern können.